Laboratorio de Biología Molecular de Interacciones Parásito-Hospedero (BiMIPHo)
Directora:
Integrantes:
Lic. García, Lucía

Integrantes del laboratorio BiMIPHo. De izquierda a derecha: María Eugenia Ancarola, Marcela Cucher, Lucía García.
En nuestro grupo tenemos como objetivo general identificar mecanismos de interacción parásito-hospedero involucrados en el establecimiento y persistencia de parásitos helmintos de relevancia sanitaria con la finalidad de proveer información relevante para mejorar el desarrollo de nuevos tratamientos y herramientas diagnósticas de las zoonosis que causan. En particular, nos centramos en el estudio de los mecanismos subyacentes al intercambio de ARNs pequeños entre parásitos helmintos y sus hospederos.
Históricamente, se ha estudiado la interacción helminto-hospedero mediante la caracterización de las proteínas secretadas en productos de excreción/secreción (E/S). En la actualidad, sabemos que los productos de E/S de animales están compuestos no sólo por proteínas secretadas sino también por vesículas extracelulares (VE), las cuales representan partículas subcelulares compuestas por lípidos, proteínas, hidratos de carbono y ácidos nucleicos. Las VE además funcionan como mensajeros intercelulares, debido a que pueden ser internalizadas por células blanco. Este tipo de mecanismo de comunicación intercelular alcanza una nueva dimensión en el contexto de la interacción parásito-hospedero, en donde hasta el momento, se ha descripto la secreción de VE en los tres grupos principales de helmintos parásitos (nematodos, trematodos y cestodos).
Además, a mediados de los 2000, se determinó que las células de animales secretan ARNs tanto in vitro como in vivo, que al ser internalizados causan un efecto en las células receptoras. Dichos ARNs pueden ser secretados de tres formas: en VE, asociados a lipoproteínas o en complejos ribonucleoproteicos solubles. Mayoritariamente, se observó que los parásitos secretan ARNs pequeños (< 200 nt), dentro de los cuales se encuentran los microRNAs. Esta clase de ARNs modula de forma negativa la expresión de transcriptos blanco, disminuyendo sus niveles intracelulares.
El intercambio de este tipo de ARNs implicaría un nuevo mecanismo mediante el cual los parásitos modulan el ambiente impuesto por el hospedero. Empleando distintos sistemas in vitro con líneas celulares u organoides, se demostró que las VE de parásitos son internalizadas por el hospedero, causando diversos efectos relacionados con la patología que producen, los cuales pueden deberse a la acción de los miRNAs que transportan.
Nuestras líneas de investigación tienen como eje central los ARNs extracelulares secretados por cestodos y sus hospederos. Nos interesa identificar y caracterizar los biotipos de ARNs secretados in vitro y en el contexto de la infección, los vehículos empleados por cada organismo para asegurar su estabilidad en el medio extracelular y el rol que cumplen estas moléculas en la interacción parásito-hospedero. A su vez, empleamos esta información para buscar nuevos biomarcadores para la detección temprana, la determinación de infección activa y el seguimiento post-tratamiento de las enfermedades que causan los cestodos.
Nuestras líneas de investigación tienen como eje central los ARNs extracelulares secretados por cestodos y sus hospederos. Nos interesa identificar y caracterizar los biotipos de ARNs secretados in vitro y en el contexto de la infección, los vehículos empleados por cada organismo para asegurar su estabilidad en el medio extracelular y el rol que cumplen estas moléculas en la interacción parásito-hospedero. A su vez, empleamos esta información para buscar nuevos biomarcadores para la detección temprana, la determinación de infección activa y el seguimiento post-tratamiento de las enfermedades que causan los cestodos.

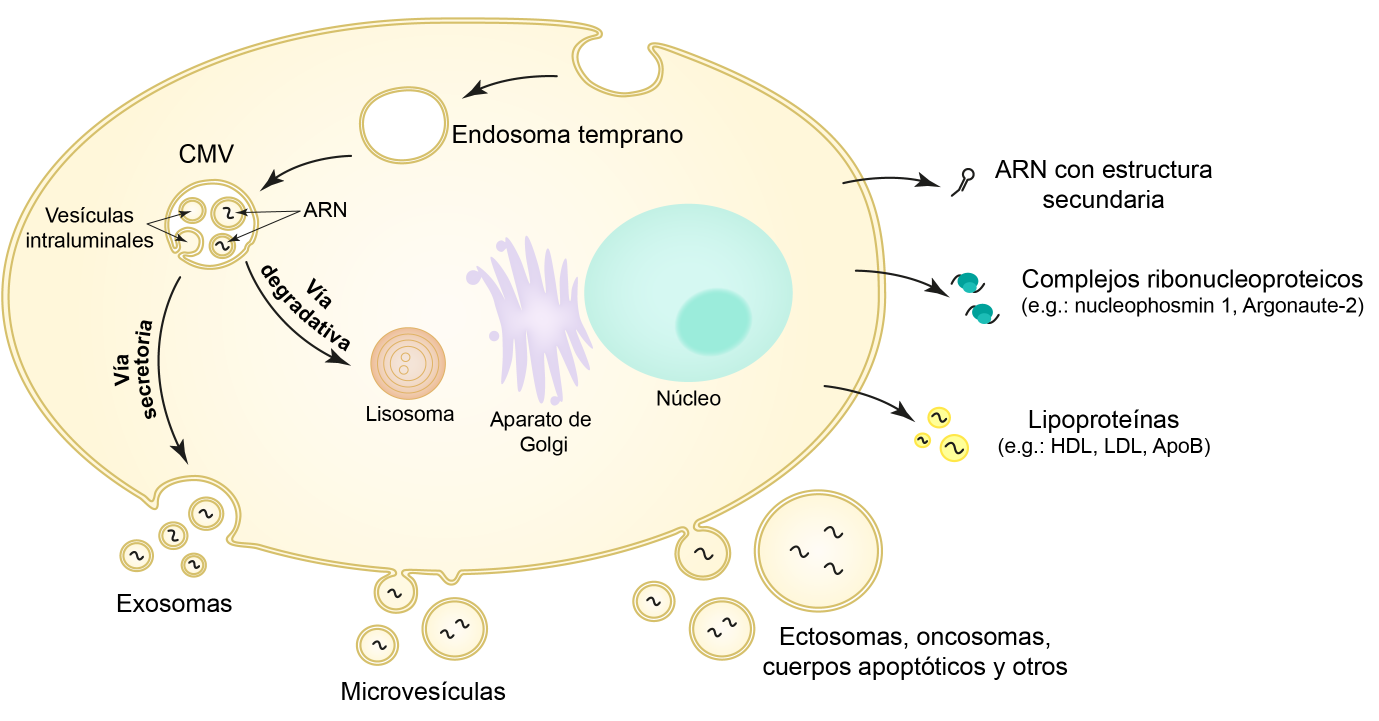
Vías de secreción/liberación de ARN en células eucariotas. Extraído de: Cucher MA, Ancarola ME, Kamenetzky L. Mol Immunol. 2021;134:150-160.
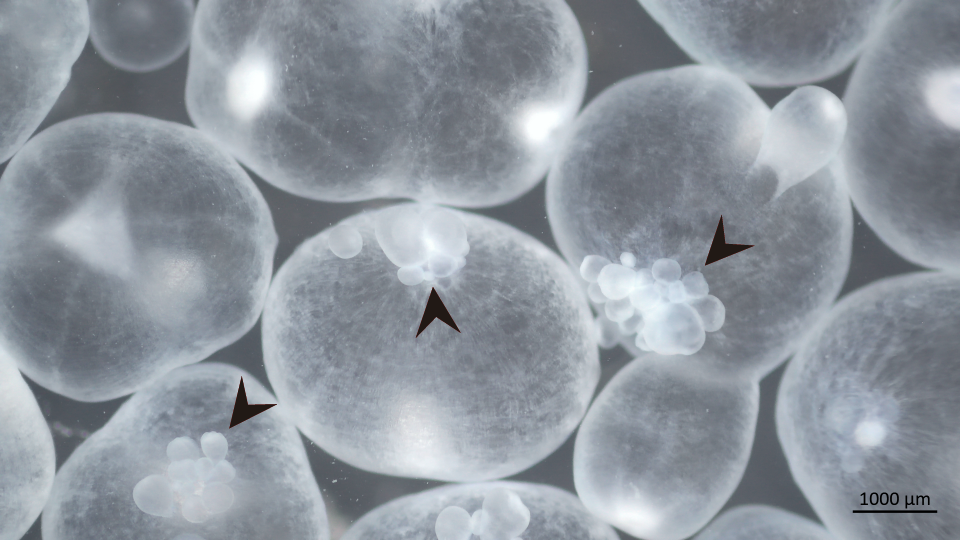
Cisticercos de Taenia crassiceps. Las puntas de flecha indican los brotes, cada uno de ellos dará origen a un nuevo cisticerco.
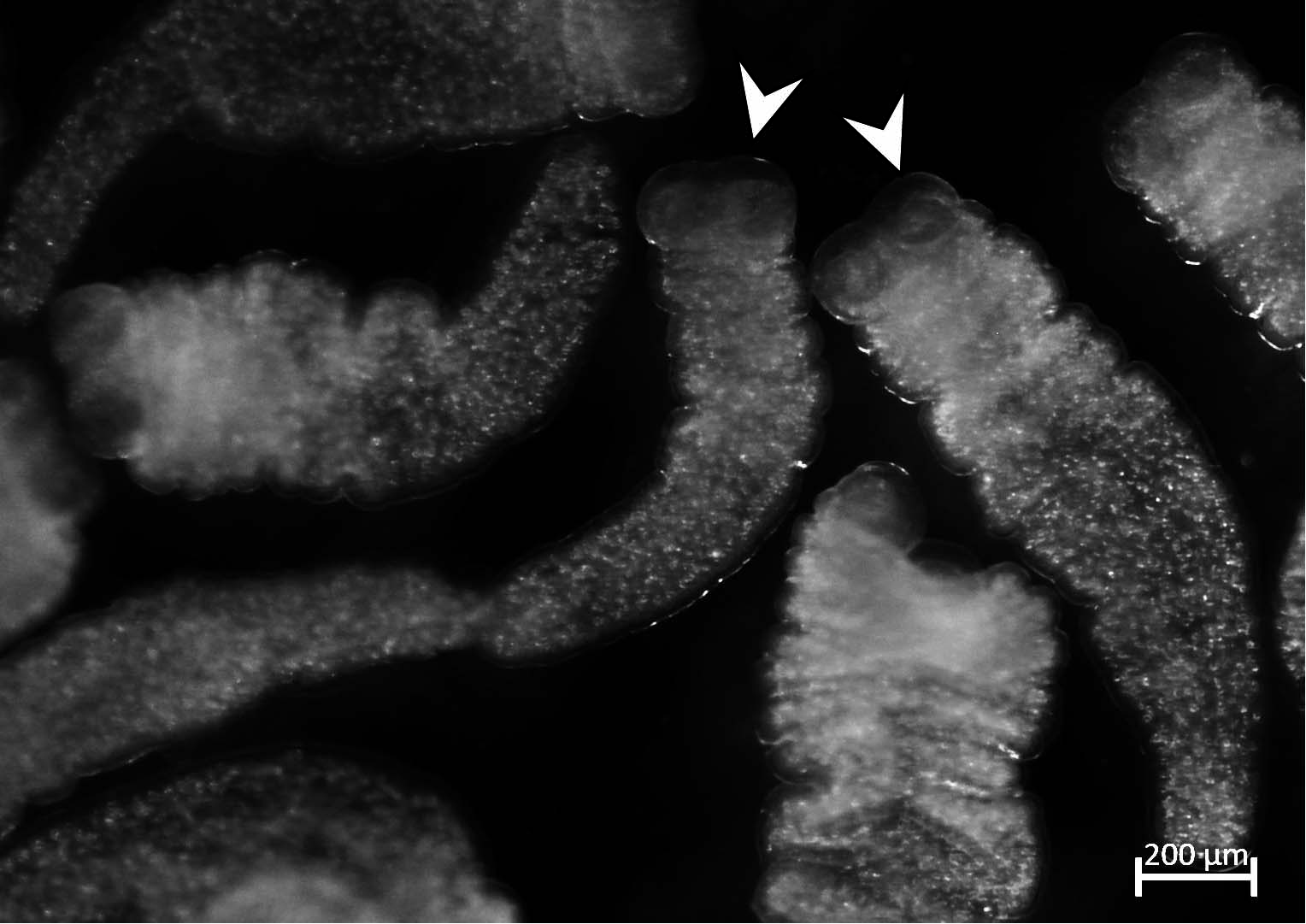
Tetratiridios de Mesocestoides corti. Las puntas de flecha indican las ventosas
Colaboradores Internacionales:
Estamos muy orgullosas de recibir el apoyo y continuo intercambio de ideas, conocimiento y entusiasmo de nuestros colaboradores:
![]() Dr. Gustavo Mourglia-Ettlin, Universidad de la República, Montevideo, Uruguay
Dr. Gustavo Mourglia-Ettlin, Universidad de la República, Montevideo, Uruguay
![]() Dr. Klaus Brehm, Universidad de Würzburg, Würzburg, Alemania
Dr. Klaus Brehm, Universidad de Würzburg, Würzburg, Alemania
![]() Dr. Guilherme Oliveira, Instituto Tecnológico Vale, Belem, Brasil
Dr. Guilherme Oliveira, Instituto Tecnológico Vale, Belem, Brasil
![]() Dr. Antonio Marcilla, Universidad de Valencia, Valencia, España
Dr. Antonio Marcilla, Universidad de Valencia, Valencia, España
![]() Dra. Krystyna Albrecht, Universidad de Würzburg, Würzburg, Alemania
Dra. Krystyna Albrecht, Universidad de Würzburg, Würzburg, Alemania
![]() Dr. Enrico Brunetti, Fundación Hospital San Mateo, Pavia, Italia
Dr. Enrico Brunetti, Fundación Hospital San Mateo, Pavia, Italia
![]() Dr. Uriel Koziol. Universidad de la República, Montevideo, Uruguay
Dr. Uriel Koziol. Universidad de la República, Montevideo, Uruguay
![]() Dra. Amy Buck, Universidad de Edimburgo, Escocia
Dra. Amy Buck, Universidad de Edimburgo, Escocia
![]() Dra. Edda Sciutto, Universidad Nacional Autónoma de México, México
Dra. Edda Sciutto, Universidad Nacional Autónoma de México, México
Participación en redes internacionales
Cooperación Europea en Ciencia y Tecnología - COST ACTION: CA20110 "Comunicación mediada por ARN entre reinos: nuevos mecanismos y estrategias en el control de patógenos". Investigadora Responsable: Dra. Amy Buck, Universidad de Edimburgo, Escocia.
Fuentes Financiadoras:
Agradecemos a las siguientes instituciones por financiar nuestro trabajo de investigación:
Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET), Argentina
Agencia Nacional de Promoción de la Investigación, el Desarrollo Tecnológico y la Innovación, Argentina
Universidad de Buenos Aires (UBA), Argentina
Fundación Bunge y Born, Argentina
Deutscher Akademischer Austauschdienst (DAAD), Alemania
Boheringer Ingelheim Fonds, Alemania
Universidad de las Naciones Unidas, Programa UNU-BIOLAC, Venezuela
Pérez Guerrero Trust Fund for South-South Cooperation, Estados Unidos de América
Publicaciones destacadas:
- Welsh JA, Goberdhan DCI, O'Driscoll L, Buzas EI, Blenkiron C, Bussolati B, Cai H, Di Vizio D, Driedonks TAP, Erdbrügger U, Falcon-Perez JM, Fu QL, Hill AF, Lenassi M, Lim SK, Mahoney MG, Mohanty S, Möller A, Nieuwland R, Ochiya T, Sahoo S, Torrecilhas AC, Zheng L, Zijlstra A, Abuelreich S, Bagabas R, Bergese P, Bridges EM, Brucale M, Burger D, Carney RP, Cocucci E, Crescitelli R, Hanser E, Harris AL, Haughey NJ, Hendrix A, Ivanov AR, Jovanovic-Talisman T, Kruh-Garcia NA, Ku'ulei-Lyn Faustino V, Kyburz D, Lässer C, Lennon KM, Lötvall J, Maddox AL, Martens-Uzunova ES, Mizenko RR, Newman LA, Ridolfi A, Rohde E, Rojalin T, Rowland A, Saftics A, Sandau US, Saugstad JA, Shekari F, Swift S, Ter-Ovanesyan D, Tosar JP, Useckaite Z, Valle F, Varga Z, van der Pol E, van Herwijnen MJC, Wauben MHM, Wehman AM, Williams S, Zendrini A, Zimmerman AJ; MISEV Consortium; Théry C, Witwer KW. Minimal information for studies of extracellular vesicles (MISEV2023): From basic to advanced approaches. J Extracell Vesicles. 2024 Feb;13(2):e12404. doi: 10.1002/jev2.12404.
- Ancarola ME, Maldonado L, García LCA, Franchini GR, Mourglia-Ettlin G, Kamenetzky L, Cucher MA. A Comparative Analysis of the Protein Cargo of Extracellular Vesicles from Helminth Parasites. Life 2023, 13(12), 2286; https://doi.org/10.3390/life13122286.
- Grecco A, Macchiaroli N, Pérez MG, Casulli A, Cucher MA, Rosenzvit MC. microRNA silencing in a whole worm cestode model provides insight into miR-71 function. Int J Parasitol. 2023, 53(13):699-710. doi: 10.1016/j.ijpara.2023.08.002.
- Cucher M, Mariconti M, Manciulli T, Vola A, Rosenzvit M, Brehm K, Kamenetzky L, Brunetti E. Circulating Small RNA Profiling of Patients with Alveolar and Cystic Echinococcosis. Biology 2023, 12(5), 715; https://doi.org/10.3390/biology12050715.
- White R, Sotillo J, Ancarola ME, Borup A, Boysen AT, Brindley PJ, Buzás EI, Cavallero S, Chaiyadet S, Chalmers IW, Cucher MA, Dagenais M, Davis CN, Devaney E, Duque-Correa MA, Eichenberger RM, Fontenla S, Gasan TA, Hokke CH, Kosanovic M, Kuipers ME, Laha T, Loukas A, Maizels RM, Marcilla A, Mazanec H, Morphew RM, Neophytou K, Nguyen LT, Nolte-'t Hoen E, Povelones M, Robinson MW, Rojas A, Schabussova I, Smits HH, Sungpradit S, Tritten L, Whitehead B, Zakeri A, Nejsum P, Buck AH, Hoffmann KF. Special considerations for studies of extracellular vesicles from parasitic helminths: A community-led roadmap to increase rigour and reproducibility. J Extracell Vesicles. 2023 Jan;12(1):e12298. doi: 10.1002/jev2.12298.
- García LCA, Pérez MG, Ancarola ME, Rosenzvit MC, Cucher MA. In vitro system for the growth and asexual multiplication of Taenia crassiceps cysticerci. Parasitology. 2022 Nov;149(13):1775-1780. doi: 10.1017/S0031182022001354.
- Kamenetzky L, Maldonado LL, Cucher MA. Cestodes in the genomic era. Parasitol Res. 2022 Apr;121(4):1077-1089. doi: 10.1007/s00436-021-07346-x.
- Miles S, Magnone J, García-Luna J, Ancarola ME, Cucher M, Dematteis S, Frischknecht F, Cyrklaff M, Mourglia-Ettlin G. Ultrastructural characterization of the tegument in protoscoleces of Echinococcus ortleppi. Int J Parasitol. 2021 Nov;51(12):989-997. doi: 10.1016/j.ijpara.2021.05.004.
- Cucher MA, Ancarola ME, Kamenetzky L. The challenging world of extracellular RNAs of helminth parasites. Mol Immunol. 2021 Mar 25;134:150-160. doi: 10.1016/j.molimm.2021.03.011
- Ancarola ME, Lichtenstein G, Herbig J, Holroyd N, Mariconti M, Brunetti E, Berriman M, Albrecht K, Marcilla A, Rosenzvit MC, Kamenetzky L, Brehm K, Cucher M. Extracellular non-coding RNA signatures of the metacestode stage of Echinococcus multilocularis. PLoS Negl Trop Dis. 2020 Nov 30;14(11):e0008890. doi: 10.1371/journal.pntd.0008890.
- Sotillo J, Robinson MW, Kimber MJ, Cucher M, Ancarola ME, Nejsum P, Marcilla A, Eichenberger RM, Tritten L. The protein and microRNA cargo of extracellular vesicles from parasitic helminths - current status and research priorities. Int J Parasitol. 2020 Aug;50(9):635-645. doi: 10.1016/j.ijpara.2020.04.010.
- Pérez MG, Spiliotis M, Rego N, Macchiaroli N, Kamenetzky L, Holroyd N, Cucher MA, Brehm K, Rosenzvit MC. Deciphering the role of miR-71 in Echinococcus multilocularis early development in vitro. PLoS Negl Trop Dis. 2019 Dec 27;13(12):e0007932. doi: 10.1371/journal.pntd.0007932.
- Ancarola ME, Marcilla A, Herz M, Macchiaroli N, Pérez M, Asurmendi S, Brehm K, Poncini C, Rosenzvit M, Cucher M. Cestode parasites release extracellular vesicles with microRNAs and immunodiagnostic protein cargo. Int J Parasitol. 2017 Sep;47(10-11):675-686. doi: 10.1016/j.ijpara.2017.05.003.
- Maldonado LL, Assis J, Araújo FM, Salim AC, Macchiaroli N, Cucher M, Camicia F, Fox A, Rosenzvit M, Oliveira G, Kamenetzky L. The Echinococcus canadensis (G7) genome: a key knowledge of parasitic platyhelminth human diseases. BMC Genomics. 2017 Feb 27;18(1):204. doi: 10.1186/s12864-017-3574-0.
- Cucher MA, Macchiaroli N, Baldi G, Camicia F, Prada L, Maldonado L, Avila HG, Fox A, Gutiérrez A, Negro P, López R, Jensen O, Rosenzvit M, Kamenetzky L. Cystic echinococcosis in South America: systematic review of species and genotypes of Echinococcus granulosus sensu lato in humans and natural domestic hosts. Trop Med Int Health. 2016 Feb;21(2):166-75. doi: 10.1111/tmi.12647.
- Cucher M, Macchiaroli N, Kamenetzky L, Maldonado L, Brehm K, Rosenzvit MC. High-throughput characterization of Echinococcus spp. metacestode miRNomes. Int J Parasitol. 2015 Mar;45(4):253-67. doi: http://10.1016/j.ijpara.2014.12.003.
- Tsai IJ, Zarowiecki M, Holroyd N, Garciarrubio A, Sánchez-Flores A, Brooks KL, Tracey A, Bobes RJ, Fragoso G, Sciutto E, Aslett M, Beasley H, Bennett HM, Cai X, Camicia F, Clark R, Cucher M, De Silva N, Day TA, Deplazes P, Estrada K, Fernández C, Holland PWH, Hou J, Hu S, Huckvale T, Hung SS, Kamenetzky L, Keane JA, Kiss F, Koziol U, Lambert O, Liu K, Luo X, Luo Y, Macchiaroli N, Nichol S, Paps J, Parkinson J, Pouchkina-Stantcheva N, Riddiford N, Rosenzvit M, Salinas G, Wasmuth JD, Zamanian M, Zheng Y; Taenia solium Genome Consortium, Cai J, Soberón X, Olson PD, Laclette JP, Brehm K, Berriman M. The genomes of four tapeworm species reveal adaptations to parasitism. Nature. 2013 Apr 4;496(7443):57-63. doi: 10.1038/nature12031.


